Médecine régénérative
Suite à une maladie ou à un accident, il est commun d’avoir besoin d’un nouveau tissu ou même d’un organe entier pour remplacer celui endommagé. La médecine régénérative a pour but de produire de novo les cellules rendues non-fonctionnelles et de cultiver des tissus sains. Dans un futur lointain, il devrait même être possible de cultiver des organes entiers. L’espoir serait alors de guérir des maladies telles que la maladie de Parkinson, la leucémie et les infarctus ainsi que certaines blessures. Au contraire des procédures habituelles visant à la réparation des tissus endommagés, la médecine régénérative vise à la production et à l’utilisation de nouveaux tissus – il s’agit d’une approche révolutionnaire au niveau de la biomédecine. La médecine régénérative joue un rôle de plus en plus important dans les milieux de l’industrie pharmaceutique et de l’industrie cosmétique. Le développement de cellules de la peau artificielles permet, par exemple, de tester de nouvelles molécules et ainsi de réduire le nombre d’expérimentations animales nécessaires.
La médecine régénérative est un domaine de recherche multidisciplinaire où biologistes, scientifiques des matériaux, bio-informaticiens et ingénieurs travaillent de pair. Il existe quatre technologies différentes dans le domaine: la régénération intrinsèque à notre corps, la thérapie cellulaire, le tissue engineering (cf. bas de page) et la thérapie génique. Les organismes modèles utilisés pour la recherche sur les bases de la capacité de régénération sont, par exemple, l’axolotl (une sorte de salamandre) ou le poisson zèbre. Il s’agit là de deux organismes maîtres dans l’art de la régénération. Ils sont capables de faire croître de novo des parties de leur cerveau ou même des membres entiers. Les connaissances ressortant d’une telle recherche sont en partie applicables chez l’humain.

Afin d’unir la recherche de base à l’application clinique, et afin de faire avancer la recherche clinique en Suisse, un centre de compétences régional dans le domaine de la médecine régénérative a été ouvert le 1er novembre à Zurich. Il s’agit là d’un pas important afin d’établir ce domaine de recherche en Suisse et de viser à son application au niveau médical. Cependant, le rêve d’une réserve de pièces de rechange pouvant être utilisées afin de réparer les organes défectueux reste aujourd’hui encore une utopie.
La régénération intrinsèque à notre corps et la thérapie cellulaire
En 1986, la transplantation allogène de cellules souches hématopoïétiques a pour la première fois été utilisée avec succès, menant au traitement d’une maladie immunitaire sévère nommée « déficit immunitaire combiné sévère lié au chromosome X (X-SCID) ». De nos jours, l’utilisation de cellules souches, provenant de la moelle osseuse d’un donneur sain immunologiquement compatible, pour le traitement de leucémies, est une procédure routinière. Il existe en fait un grand nombre de maladies pour lesquelles les cellules souches ont le potentiel de mener à une guérison. Pour certaines d’entre elles, des études cliniques sont déjà en cours. L’attention de la recherche se porte en particulier sur les cellules possédant une capacité de régénération limitée.
Nous avons plus de 200 cellules différentes dans notre corps. Certaines d’entre elles ont une capacité de régénération étonnante. Par exemple, la totalité de la surface de notre peau se renouvelle en à peine deux semaines. Notre intestin, notre foie et nos cellules de moelle osseuse ont également un fort pouvoir régénératif. D’autres parties de notre corps, comme par exemple les cellules du cœur, les os et le cartilage, ne possèdent au contraire qu’une capacité de régénération limitée.
L’utilisation de cellules souches pour le traitement de maladies cardiaques est par conséquent un exemple de l’intérêt thérapeutique de telles cellules. Lors d’un infarctus, les cellules musculaires du cœur sont irréversiblement endommagées. Une possibilité pouvant mener à l’amélioration de la fonction cardiaque suite à un infarctus serait d’injecter des cellules souches adultes, isolées de la moelle osseuse, autour du muscle cardiaque affecté. Bien que les cellules endommagées ne puissent être ainsi remplacées, une étude clinique (nommée étude PERFECT) a montré que les mécanismes naturels de réparation peuvent ainsi être activés et la fonction cardiaque améliorée. L’utilisation de cellules souches adultes pour la régénération cardiaque est cependant une approche très débattue.
Au contraire de la culture en laboratoire de cellules cardiaques, la culture de cellules de cartilage destinées à la guérison de dommages au niveau du ménisque ou des disques intervertébraux, est à un stade avancé et est même déjà utilisée comme traitement.
Il en est autrement au niveau des os. La capacité de régénération des os est, particulièrement chez les personnes âgées, fortement réduite. Actuellement, les chercheurs se penchent sur l’utilisation de cellules souches adultes, isolées de la moelle osseuse, comme traitement des fractures osseuses. Les premiers essais thérapeutiques, au cours desquels des cellules souches ont été injectées directement au niveau des fractures osseuses, chez des personnes âgées, ont été un succès. Les cellules souches étant cependant elles aussi âgées (ayant été prélevées directement sur les patients âgés), elles présentent une capacité de régénération diminuée et cette méthode reste donc à optimiser.
Des thérapies semblables utilisant des cellules souches embryonnaires et visant au traitement de la maladie de Parkinson, du diabète ou encore des accidents vasculaires cérébraux, sont actuellement en phase de test où elles démontrent des résultats prometteurs. Cependant, des études additionnelles sont encore nécessaires avant de tester leur efficacité sur des patients.
Les bioréacteurs servent d’incubateurs à la génération de tissu produit artificiellement. Ils permettent un réglage précis de la température et du pH ainsi qu’une nutrition optimale. Un stress mécanique et chimique assure de plus aux cellules une résistance aux pressions corporelles. Les bioréacteurs sont donc la base nécessaire à la production d’un grand nombre des 200 types cellulaires différents présents dans notre corps.
Tissue Engineering
Dans les années 80, le tissue engineering a subi un boom. Il a été pour la première fois possible de produire artificiellement du tissu humain, plus précisément de la peau artificielle. De nos jours, cette peau artificielle est produite à partir de cheveux ou de petits morceaux de peau et est utilisée, par exemple, pour le traitement des grands brûlés et dans l’industrie (cosmétiques et tests pharmacologiques). Au niveau des racines des cheveux se trouvent des cellules souches adultes capables de former des cellules de la peau. Au contraire des cellules de peau différenciées, les cellules souches adultes de racines de cheveux se divisent beaucoup plus rapidement et peuvent ainsi s’implanter plus rapidement. Pour les victimes de brûlures, il s’agit là d’un avantage déterminant. Depuis 2011, il existe à Stuttgart une installation de production automatisée pour la culture 3D de l’épiderme. La peau artificielle ne peut cependant pas être utilisée pour remplacer une grande partie du corps brûlée étant donné que des composants tels les glandes sudoripares et les terminaisons nerveuses, manquent. Dans ces cas de figure, la transplantation de peau de remplacement est l’approche choisie. La recherche portant sur la production de peau artificielle identique à la peau normale est de nos jours très intense.
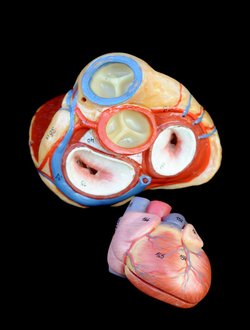 Un autre exemple de tissue engineering concerne les valves cardiaques artificielles. Les valves cardiaques sont aujourd’hui produites en majorité à partir de matériel synthétique. Comme ces valves cardiaques ne croissent pas avec la croissance corporelle, les enfants nécessitant de telles valves synthétiques doivent répétitivement être soumis à une opération à risque. Pour cette raison, les chercheurs se penchent actuellement sur le développement de valves cardiaques naturelles. Pour le moment, deux approches coexistent. La première approche consiste en l’arrangement de cellules sur une structure formée de fibrine. Cela résulte en la production d’une valve cardiaque fonctionnelle en six semaines. La deuxième méthode consiste en l’utilisation d’une valve cardiaque prélevée chez un donneur. Cette valve est traitée en laboratoire afin que seule la structure soit préservée. Cette structure est alors recouverte de cellules souches provenant du patient afin de mener au développement d’une valve cardiaque. Les deux approches ont fait leurs preuves une fois testées sur un modèle animal. Elles ont démontré avoir la capacité de croître en même temps que le corps.
Un autre exemple de tissue engineering concerne les valves cardiaques artificielles. Les valves cardiaques sont aujourd’hui produites en majorité à partir de matériel synthétique. Comme ces valves cardiaques ne croissent pas avec la croissance corporelle, les enfants nécessitant de telles valves synthétiques doivent répétitivement être soumis à une opération à risque. Pour cette raison, les chercheurs se penchent actuellement sur le développement de valves cardiaques naturelles. Pour le moment, deux approches coexistent. La première approche consiste en l’arrangement de cellules sur une structure formée de fibrine. Cela résulte en la production d’une valve cardiaque fonctionnelle en six semaines. La deuxième méthode consiste en l’utilisation d’une valve cardiaque prélevée chez un donneur. Cette valve est traitée en laboratoire afin que seule la structure soit préservée. Cette structure est alors recouverte de cellules souches provenant du patient afin de mener au développement d’une valve cardiaque. Les deux approches ont fait leurs preuves une fois testées sur un modèle animal. Elles ont démontré avoir la capacité de croître en même temps que le corps.
